
一、背景介绍
在3D打印过程中,重力有助于材料沉积,但也会在打印物体上增加恒定的向下力,这会导致打印物体变形或塌陷,尤其是在存在悬垂或薄特征的情况下。为了应对这些挑战,已经开发了支撑浴方法。支撑浴槽材料应表现出宾汉塑料的性能:当受到来自移动喷嘴的压力时,它应该流态化,允许打印材料挤出,并在消除应力时迅速恢复到固态,确保印刷油墨牢牢地保持在浴槽内。此外,支撑槽还应有助于交联,以避免油墨扩散。因此,尽管支撑浴方法提供了许多好处,但其广泛应用现在受到高质量支撑材料有限以及优化切片和打印参数以匹配打印材料和支撑材料特性所需的努力和专业知识的阻碍。
与精密的3D结构相比,平面结构更容易直接制造成许多所需的形状。因此,2D到3D 转换策略将能够从更容易获得、更低维的结构中设计3D结构。以前的研究表明,空间变化的各向异性膨胀、压缩屈曲、材料内的内应力、形状记忆材料和表面张力驱动的浮动可以触发2D到3D转换等。这些方法有助于以更低的成本和时间制造复杂的3D几何形状,并随后导致了4D打印技术的发展,其中材料可以适应不断变化的环境。然而,目前的策略在形状变形过程中只提供浅弯曲或滚动,因为它们依赖于材料的内在特性来触发变形,并且依赖于通常不适合细胞培养的具有响应特性的专用材料。因此,需要替代方法来实现大变形、大规模创建复杂结构以及使用各种生物相容性材料。
在这项研究中,提出了一种简单而通用的3D生物制造使用远程控制的磁力将2D水凝胶前驱体转化为复杂的3D形态(图1和2A)。3D形态由转化后的浮力、重力和磁力的组合支撑,因此无需物理支撑。在水凝胶中掺入生物相容性和热响应性明胶网络作为牺牲支持,以便在聚合物交联之前形成结构。牺牲磁性墨水和重力墨水也被用来协助控制2D到3D的转变。这些牺牲墨水随后可以去除,留下完整的3D生物支架。此策略允许通过调整初始2D 形状、温度或磁点和重力点的空间分布等因素来实现可编程的形状变形。使用这种形状变形策略从多种生物相容性水凝胶设计3D生物支架,包括明胶、甲基丙烯酸化明胶 (GelMA)、甲基丙烯酸化透明质酸(HAMA)、甲基丙烯酸酯葡聚糖(DexMA)和藻酸盐。此外,在可交联的块状水凝胶中构建了3D分支血管通道,随后表明这些3D通道是可灌注的并且可以内皮化。还生成了用于制造3D软致动器的弯曲的薄壁生物支架。总体而言,使用远程力支持脆弱的3D结构的开发概念提供了一种独特的形状变形和3D制造策略,适用于各种材料系统,从而为高效的3D生物制造开辟了新的可能性,使生物学、生物医学工程、软材料和软机器人领域的研究人员受益。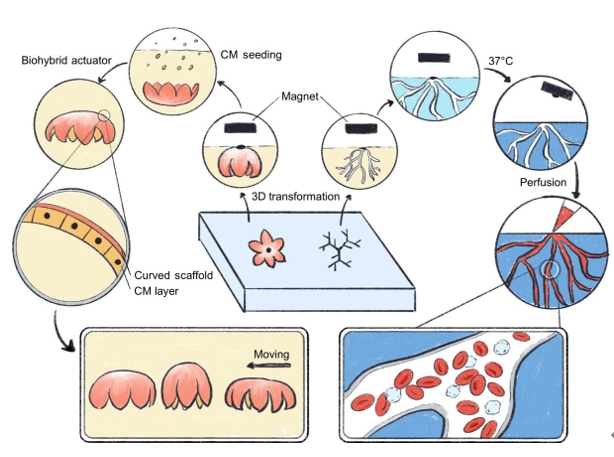
2.1 平面水凝胶支架的制造
扁平水凝胶支架可以使用3D生物打印机 (SunP BioMaker 2) 制造。将20% (w/v) 明胶前体溶液加载到带有金属尖端的5 ml移液器中,并引入温度为45°C的加热打印机喷嘴中。 明胶生物墨水在涂有40% (w/v) Pluronic F-127溶液薄层的预冷打印床(4°C)上打印之前保持平衡。层高0.3 mm,打印速度12 mm/s,挤出速度1.6 mm3/s 被发现是最优的。打印后,将磁性墨水和重力墨水添加到打印图形的所需部分,使墨水在4°C打印床上融合5分钟。
三、结果
3.1 磁力驱动的3D转换
水凝胶支架从平面到3D的转变是通过使用磁力的远程控制完成的。扁平水凝胶前驱体由三部分组成:主支架材料,它将形成最终的结构,以及牺牲磁性墨水和重力墨水,这将有助于3D转换。所有组分都含有物理可交联的明胶,可以暂时将油墨固定在适当的位置。由氧化铁颗粒和明胶组成的磁性墨水被放置在平面水凝胶的中心;而由碳酸钙和明胶组成的重力墨水位于末端(图2A、i)。由于明胶的物理交联特性,这些油墨在温度降低时会在所需的沉积点迅速凝固。为了尽量减少对精密水凝胶支架的损坏,当支架浸入水浴中时完成转换,从而暴露在浮力下,浮力部分抵消了重力的影响,并防止整个结构在形状变形过程中过度下垂(图2A、ii)。施加外部磁场使磁点暴露在向上的磁力下,抬起水凝胶支架,并在向下引力(图2A、ii)。在本文中浮力、重力和磁力的结合保持了3D结构,直到材料完全交联和凝固,从而消除了对固体材料的物理支撑的需求。
这种方法生成类似于3D血管网络的复杂分支结构的可行性。由于3D打印允许灵活设计和快速原型制作具有复杂特征的支架,因此基于挤压的3D打印机制造了扁平水凝胶前驱体。在打印过程中,打印喷嘴被加热到45°C,以确保材料顺利挤出,同时打印床被冷却到4°C,以确保挤出后材料快速固化。2D水凝胶前驱体是使用CAD (图2B、i)中打印,然后使用基于挤压的3D打印机打印(图2B、ii)。浸入水浴后,施加外部磁场以触发3D变换 (图2B、iii)。3D网络可以在几秒钟内获得,并且只要施加磁力,就可以在3D中持续存在(视频1)。通过基于直接挤出的打印生成这些3D分支结构将非常困难,因为这些精密结构往往会在自身重量下塌陷。然而,通过使用磁驱动变形策略,打印的扁平水凝胶分支可以很容易地图案化成复杂的3D形状。因此,这种磁力驱动的转换方法克服了当前模塑和基于挤出打印的一些限制,可以创建精致的3D结构,同时保持灵活性和可扩展性。
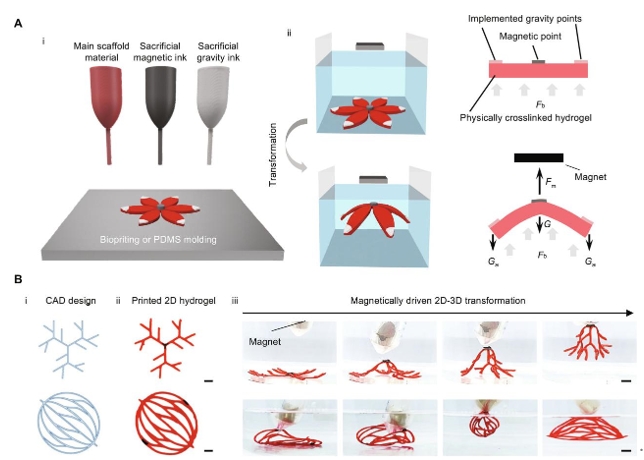
图2. 基于磁驱动变换的制造策略概念。(A) 示意图显示(i)材料沉积成扁平水凝胶前驱体,(ii)在磁体应用时浸没转化为3D形态。Fm表示施加在水凝胶上的磁力Fb表示浮力,G表示脚手架材料的重力,G一个表示额外实现的重力油墨的重力。(B)使用磁驱动变换策略对3D分支血管几何形状进行4D打印。几何设计在 AutoCAD(i)中生成,打印成扁平水凝胶前驱体(ii),然后使用磁铁(iii)转换为3D分支几何。
3.2 对3D变换的多模态控制
用于暂时固化平面水凝胶前驱体的明胶是一种常用的温度响应材料,随着温度的升高,它会发生凝胶到溶胶的转变(图3A)。使用20% (w/v) 明胶检查温度对转变的影响,并使用流变测量来评估材料对温度的响应。结果表明,20% (w/v)明胶的剪切模量从20°到30°C略有下降,但超过30°C后表现出显着下降。在水凝胶前驱体的转变过程中,从22°C到33°C的温度扫描证实,剪切模量的降低增加了变形能力(图3A、ii)。结果表明,支架在28°C以下表现出最小的变形,并且转变的程度随着温度的增加而增加,直到支架在33°C时开始熔化。 此外,曲率半径的测量揭示了水浴温度与实现的形状变形程度(图3B)。当温度从22°升高到28°C时,转换结构的曲率半径保持相对恒定,但在28°C以上的温度下大幅下降(图3B)。当磁性油墨和重力油墨的数量保持不变时,30°C的水浴温度与25°C相比,所有测试形状的3D结构渲染都非常出色。因此,控制温度能够调整水凝胶前驱体的模量,并随后进行形状转变。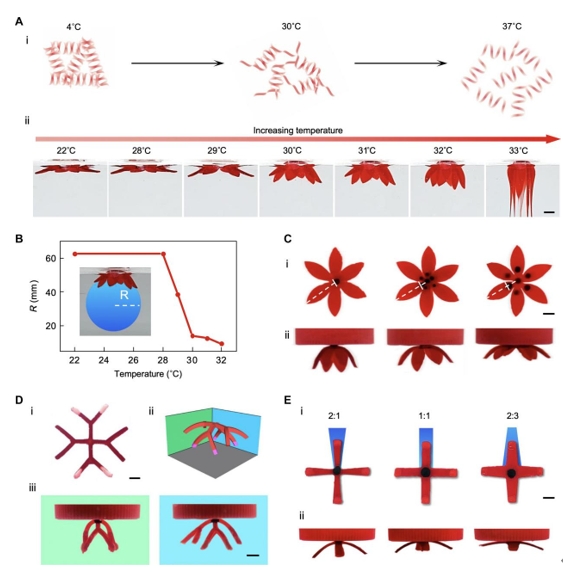
图3. 对磁驱动变换的多模态控制。(A) (i)显示明胶从凝胶状态到溶胶状态的热响应的方案。(ii)花形水凝胶前驱体在不同温度下的转变,直到它在33°C下熔化。(B)随着温度的升高,将花形水凝胶前驱体置于水中时的曲率半径(R)。在转换的水凝胶支架的图像下绘制一个蓝色圆圈来测量半径。(C)磁心对3D变换的影响。(i)磁中心面积增加的扁平水凝胶前驱体(白色虚线突出显示每个水凝胶前驱体的磁心边缘及其与中心和水凝胶前驱体边缘的距离)和(ii)前驱体的相应3D变换。(D)重力墨水对3D变换的影响。(i)具有两个带有重力墨水(白色尖端)的分支和两个没有的分支的扁平水凝胶前体。(ii)从两个不同角度观察时具有不同弯曲程度的转化前驱体的示意图和(iii)实验图像。(E)二维前驱体结构设计的影响。(i)具有不同边缘与中心分支宽度比(2:1、1:1和2:3) 的扁平水凝胶前驱体和相应的3D转换;(ii)前驱体的相应3D变换。
磁性墨水的空间分布和重力墨水的体积分别负责驱动变形的磁力和重力,也可以进行调整以提供形状变形控制。磁点的位置会影响转换结构的形态,因为它决定了支架的夹紧点(图 3C)。当磁点的距离更接近末端时,结构的曲率半径增加,表明变换减少。增加重力油墨的体积会增加重力提供的向下驱动力,从而导致更高程度的形状变形(图3D)。此外,2D结构的原始设计会影响弯曲程度,因此创建了形状相似但在弯曲点处连接程度不同的结构(图3E),发现在弯曲点处具有更多连接的结构表现出较弱的弯曲。
由于磁力会触发变形过程,因此预计更多磁体的实施会引入更复杂的磁力,从而可能触发更通用的3D转换。如图4所示,通过使用两个磁铁固定2D水凝胶前驱体的两端,然后扭曲结构,可以轻松地将两条链编织成一个交织在一起的双螺旋线。在这种结构中,带有红色和蓝色食用染料的明胶,用于代表两种不同的材料,可以很容易地被其他材料取代,从而实现多材料支架。同样,梯状2D水凝胶前体可以转化为类似DNA的双螺旋结构(图4B)。细长的梯状扁平水凝胶前驱体的进一步扭曲可导致编织的管状结构(图4C)。在两个磁铁的作用下,四个角上有四个磁点的扁平水凝胶网可以立即卷成3D管状网(图4、D和E)。因此,可以通过调节温度、通过磁性和重力油墨的受控沉积来操纵相反的力,以及修改原始2D结构的设计,从而微调2D水凝胶前驱体向3D形态的形状变形。此外,磁点可以用作动态锚点,从而实现对转换的复杂控制。
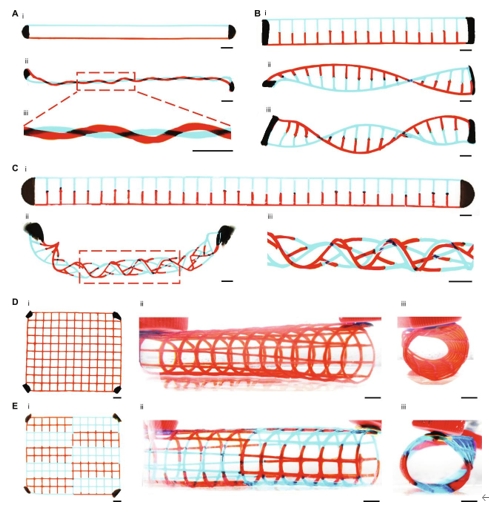
图 4. 使用多磁体对3D结构进行图案化。(A)在两个磁铁的帮助下,两股(i)之前和(ii和iii)被扭曲成双交织的螺旋线。(B)转化前(i)和转化后(ii和iii)的DNA样双螺旋结构。变形的3D双螺旋链,包含(ii)一个结和(iii)两个结。(C)将(i)细长的梯状扁平水凝胶前驱体扭曲成(ii和iii)编织管状结构。(D和E) 3D管状网片由(D)均质和(E)异质水凝胶网壁组成。(i)包含四个磁性墨点的扁平水凝胶前驱体。(II和III)3D管状网格的不同视图。
3.3 变换的支架的牺牲模板以创建3D分支通道
3D血管分支网络的开发可以改善组织工程结果。为了探索了磁转化策略来创建具有3D可灌注分支通道的生物支架,选择了20% (w/v)明胶来制造2D水凝胶前体,在3D转化后,可以在细胞友好温度下牺牲这些前体以产生通道。
因为GelMA预聚物可以在紫外线(UV)下轻松交联,并且具有适合组织工程应用的生物相容性,所以用于交联水凝胶浴。当施加磁场时,2D 明胶前驱体转化为3D形态,(图5A、i)作为浸没的牺牲凝胶。然后在紫外线照射下交联GelMA预聚物,将浸没的牺牲凝胶固定在交联的GelMA中。然后将由20% (w/v)明胶制成的浸没牺牲凝胶,然后在37°C(图5A、ii),导致生成可灌注支架(图5A、iii)。还模拟了磁场分布(图5B、i)。磁体的北极和南极平行于xz平面,中心线指向浸没的牺牲凝胶。xz平面上的磁场强度随着与磁体(图5B).这一观察结果表明,施加在浸没的牺牲凝胶上的磁力可以通过改变支架和磁体之间的距离来调节。使用浮力Fb以及重力G和G一个保持恒定,浸没的牺牲凝胶可以在调整施加的磁力(Fm)。通过实验证实,远程应用磁体会导致3D变换,如浸没在GelMA浴中和紫外线照射下的浮动分支脚手架所示(图5C)。然而,产生用于3D变换的磁场并不严格限于使用NdFeB磁体,它只产生梯度磁场。例如,以圆形或鞍形线圈对排列的电磁铁可以产生空间均匀的磁场,以进一步增强成型结构的可控性。UV交联后,将温度升高至37°C,以溶解由20% (w/v) 明胶制成的浸没牺牲凝胶,留下空心的分支通道。通过用有色染料注射通道来评估灌注质量。如图5D在图像查看器中打开,观察到染料溶液明显渗透到支管的每一段,表明通道成功形成。通过改变扁平水凝胶的设计,还实现了具有不同尺寸和几何形状的空心分支通道。
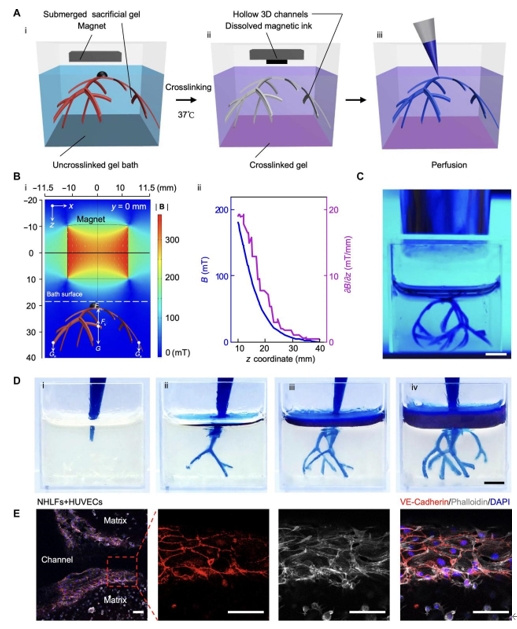
图 5. 磁驱动转化以创建具有3D分支维管通道的生物支架。(A)示意图显示了通过磁驱动转化策略制造具有3D分支维管通道的生物支架的步骤。(i)当施加磁体时,浸入未交联凝胶浴中的扁平牺牲明胶前驱体转化为3D几何形状。(ii)在紫外线下交联凝胶浴后,将交联支架置于37°C下,磁铁仍放在顶部,以溶解明胶并去除溶解的磁性墨水。(iii)显示生成的支架灌注的方案。(B)磁场分布分析。(i)施加磁体引起的磁场分布的有限元分析。(ii)沿z坐标的磁场分布。(C)牺牲前驱体转化为3D形态后支架的UV交联。(D)从(i)到(iv)演示的蓝色染料的支架灌注。(E)纤维蛋白支架中VE-钙粘蛋白(红色)、鬼笔环肽(灰色)和4',6-二脒基-2-苯基吲哚(DAPI)(蓝色)的免疫染色,其中HUVEC衬在通道壁上,NHLF在纤维蛋白基质内。
两种基于蛋白质的关键天然水凝胶广泛用于组织工程。胶原蛋白预聚物被用作沐浴材料。胶原蛋白浴在室温下发生溶胶-凝胶转变,因此随着时间的推移变得不透明。在37°C下孵育后,去除嵌入胶原蛋白浴中的浸没牺牲凝胶,形成空心通道。使用相同的策略,我们还在纤维蛋白中创建了3D分支通道并确认了它们的可灌注性。
使用了人脐静脉内皮细胞 (HUVECs),因为它们通常用于体外血管形成。首先评估了暴露于碳酸钙和氧化铁颗粒时的细胞活力。将细胞暴露在一定剂量的氧化铁颗粒中,就像它们在密度为1000万/毫升的磁性墨水或重力墨水中培养一样。结果表明,碳酸钙颗粒在2小时暴露或长期暴露组中都不会降低细胞活力。然而,氧化铁颗粒显著降低了长期暴露组的细胞活力,但2小时暴露组没有降低细胞活力。当明胶溶解时,氧化铁从明胶中释放出来,并被磁铁吸引。这种方法可确保细胞在相当长的时间内不会暴露在氧化铁颗粒中。为了评估任何残留颗粒对细胞活力的潜在影响,将细胞暴露于不同剂量的氧化铁颗粒中,并在7天的孵育期内监测细胞活力。结果表明,如果细胞在磁性墨水中以1000万/ml的密度培养,剂量减少到全剂量的10% (1/10)以下,氧化铁颗粒不会对细胞活力产生显著影响。鉴于(i)细胞不直接在磁性墨水中培养,并且(ii)磁性墨水仅占整个支架的一小部分,并且在牺牲后可以很容易地被磁铁去除,因此磁性颗粒的利用不会对掺入生物支架的细胞产生不利影响。
为了评估具有分支通道的3D支架促进组织工程应用细胞活性的能力,在GelMA生物支架中培养正常人肺成纤维细胞(NHLF)和HUVEC。培养4天后,两种细胞类型在支架内均表现出良好的活力。培养14天后,通道周围的细胞保持良好的活力并建立连接。相比之下,距离通道较远且位于凝胶内的细胞活性随着时间的推移而降低,并最终发生细胞死亡。这些结果表明,模板化通道可用于促进生物支架中的营养输送和细胞存活。值得注意的是,在中空通道周围观察到大量存在CD31,CD31是血管形成的标志物。这一观察结果证实,磁驱动转化产生的分支通道可以内皮化并用于设计血管结构。
将内皮细胞掺入牺牲凝胶中,将成纤维细胞掺入纤维蛋白浴中。在纤维蛋白浴的交联过程中,内皮细胞保留在牺牲凝胶内,而成纤维细胞位于纤维蛋白基质内。在室温下孵育30分钟后,将纤维蛋白浸入培养基中并放入培养箱中。随着牺牲凝胶溶解,内皮细胞附着在纤维蛋白支架壁上,而成纤维细胞嵌入3D纤维蛋白基质中。孵育7天后,用VE-钙粘蛋白和鬼笔环肽固定并染色纤维蛋白支架。染色进一步验证了内皮细胞在通道内生长,成纤维细胞分布在基质中(图5E)。清晰的VE-钙粘蛋白信号表明内皮细胞之间形成紧密连接,内皮细胞屏障成功形成。
3.4 3D转化的生物支架可以交联成独立结构
将其他可交联水凝胶与明胶结合使用,以创建3D变形结构。这种方法允许3D转化的水凝胶交联而不是牺牲。平面设计,无论是模制的还是打印的,都可以使用与以前相同的磁触发2D到3D转换在水中转换为3D结构。如图6A所示,一旦演变成3D配置,结构可以通过紫外线或通过在水浴中添加交联剂来交联,同时磁铁可以稳定结构。
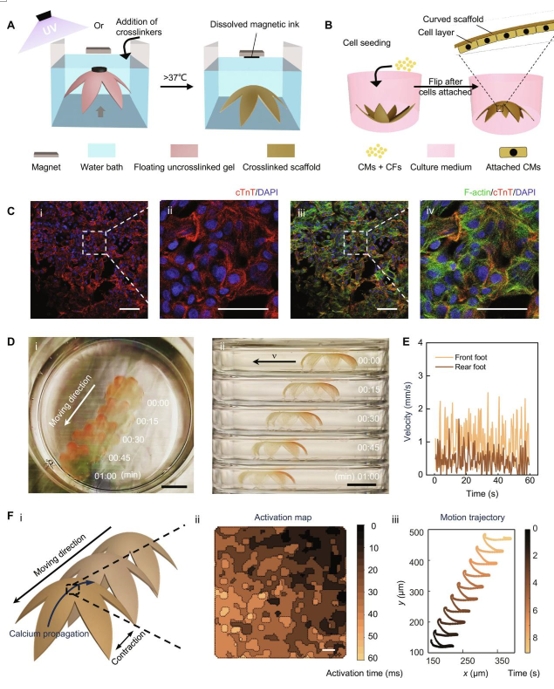
图 6. 3D薄生物支架的磁驱动转化能够产生具有行走运动的基于水凝胶的生物混合致动器。(A)方案说明了创建花形的基于3D薄膜的生物支架的过程。最初,扁平的可交联水凝胶前驱体转化为3D形态,然后在其上方放置磁铁时交联。在37°C下孵育后,交联支架将从磁体中释放出来,而明胶会溶解,同时从支架中释放磁性墨水。(B)说明生物支架上的细胞接种和层形成的方案。(C)在3D薄生物支架表面培养的心肌细胞的免疫染色。cTnT(红色)、DAPI(蓝色)和F-肌动蛋白(绿色)。(I和III)低放大倍率。比例尺,50 μm。(II和IV)高放大倍率。比例尺,25μm。(D) (i)行走生物杂交致动器的俯视图和(ii)侧视图延时照片(收集 1 分钟)。比例尺,1厘米。(E)前脚和后脚随时间变化的瞬时速度。(F) (i)支架收缩、移动和钙传播方向示意图;(ii) 支架中心心肌细胞随时间的钙传播映射(比例尺:500 μm);(iii)脚手架运动分析。
交联后,移除磁体后保持3D形态,从而产生独立的3D生物支架(图6A )。这种形状变形和交联方法可以应用于各种水凝胶系统,例如 GelMA、DexMA、HAMA和藻酸盐,所有这些系统在交联后都显示出良好的3D形态。然而,当使用UV在水下交联材料时,由于UV强度的变化,交联效率会受到材料在水下的深度的影响。为了研究这种依赖性,我们检查了GelMA的杨氏模量在15 mm深的浴溶液(深浴)和5 mm深的浴溶液中被紫外线交联多个持续时间,后者只有一个薄层覆盖材料(浅浴)。如图 1 所示。在相同的交联持续时间下,深浴组和浅浴组之间没有显著差异。交联5或10 min的组的杨氏模量显著低于交联15或20 min的组。因此,本研究中使用的浴槽深度对交联效率没有显着影响;相反,交联时间是主导因素。然而,在15分钟组和20分钟组之间没有观察到显着差异,表明在应用条件下,当GelMA暴露在紫外线下超过15分钟时,GelMA已完全固化。因此,当需要相当深的浴槽来制作大型支架时,材料可以在阈值以上的时间内交联,以确保整个支架的材料特性一致。
3.5 产生具有行走运动的基于水凝胶的生物混合致动器
接下来探索了3D薄壁生物支架在形成生物杂交致动器方面的功能效用。结合平面聚合物或水凝胶支架和心脏或肌肉细胞进行运动的生物混合致动器已被广泛研究。这些致动器成功地复制了鱼、鳐鱼或水母的游泳运动,并有可能实现模拟心脏功能的液体泵送系统。天然心脏组织具有有助于泵送的曲率,但当前生物混合致动器系统中使用的平面支架不包括此功能。此外,虽然已经研究了由心肌细胞驱动的具有行走运动的生物混合致动器,但可生物降解的软水凝胶的使用一直很少见,主要是因为难以将这些材料设计成3D薄壁支架。最近的一项研究使用应力诱导的变形来实现具有生理曲率的3D打印心脏贴片,尽管由于水凝胶支架的高机械阻力而无法实现宏观收缩。
为了应对这一挑战,探索独立式3D薄壁生物支架是否可以促进具有所需曲率和宏观收缩的生物混合致动器的开发,以及这种设计是否可以产生能够行走的生物混合机器人。选择GelMA作为支架材料是因为它能够掺入在先前文献中用于触发软生物杂交致动器变形的心肌细胞。使用花结构是因为它可以为细胞附着提供大表面,并且可以在水中自由站立以允许潜在的行走运动。
为了准备3D生物杂交致动器,准备了一种由明胶和GelMA组成的扁平水凝胶前体。将结构转化为3D构型后,对GelMA进行UV交联。支架的厚度最小化以实现细胞触发的运动。支架的厚度约为300 μm。厚度的进一步减少可能会给材料部署带来挑战,从而影响支架的可重复性。制造完成后,将支架在37°C下孵育过夜以去除明胶,从而得到最终的独立式3D薄壁生物支架(图6A)。5% (w/v) GelMA和10% (w/v) GelMA均进行了支架制造测试,后者在去除明胶后表现出更好的形状保持性和可重复性。因此,选择了由10% (w/v) GelMA制成的支架用于随后的细胞接种。将具有GCaMP指示剂衍生心肌细胞 (GCaMP hiPSC-CM)的人诱导多能干细胞(hiPSC)接种到生物支架表面,以生成生物混合3D致动器(图6B)。此外,添加了10%的心脏成纤维细胞以促进更好的心肌细胞附着和功能。
通过cTnT和F-肌动蛋白染色验证支架上的细胞(图6C),结果显示支架被心肌细胞很好地覆盖,细胞生长各向同性,细胞体或肌节没有对齐。即使没有引导细胞对齐,由于水凝胶材料薄层的低弯曲阻力,细胞层也足够坚固,可以触发整个支架的显着反复收缩和松弛(视频2)。为了实现行走运动,将生物混合 3D 致动器的弯曲面朝下。随时间的变化是从顶部和侧面记录的。从录制的视频(视频S2和S3)中,可以观察到由心肌细胞的自发跳动触发的生物混合3D致动器的运动。图6D还显示了随时间移动的生物混合3D致动器的图像。后脚和前脚之间的不同收缩力,由两只脚的不同瞬时速度表示(图6E),可能是将支架向前移动的主要驱动力。进行iPSC-CMs的钙成像以探索细胞水平的驱动。由于心肌细胞来源于GCaMP iPSC,因此钙成像可以直接通过荧光成像进行。在同一个钙成像视频中还跟踪了支架的运动。结果表明,钙的传播方向(图6F、ii)与花形软致动器的运动(图6F、iii)一致,表明iPSC-CMs的收缩导致软致动器的变形,产生类似于行走运动的有节奏的向前推力。因此,使用磁触发转化策略,成功地设计了一个仅由生物相容性水凝胶和细胞组成的3D步行致动器。这些进步有可能成为开发与生命系统交互的植入式工程组织和软机器人的使能平台。
四、讨论
本文展示了一种简单而通用的生物制造策略,可以有效地将打印和模制的扁平软水凝胶前体转化为复杂的3D结构。与以前报道的2D到3D转换策略不同,此方法不依赖于材料的内在特性。相反,响应特性来自牺牲油墨和磁场的远程应用,使其与更广泛的材料系统兼容,并克服了对精确预定材料设计的要求。还通过外力和随温度调整形状变形,可以更轻松地控制3D变形。此外,施加在支架上的远程磁力和重力消除了制造过程中对物理支撑的需求,从而可以轻松制造薄而软的生物支架。此外,这些力作用在相反的方向上,从而实现实质性的形状变形和不受高度限制的受控弯曲。这一优势能够生成分支3D血管结构,这是以前报道的2D到3D转换方法无法实现的。因此,在3D结构和材料多样性方面扩展了3D生物制造中形状变形的可能性。使用这种方法,实现了3D分支网络和由软水凝胶组成的薄膜拱结构。所得结构已用作牺牲模板来复制分支血管系统的建筑模式,或用作生物支架,支持制造具有心肌细胞触发的行走运动的生物混合软致动器。
然而,由于明胶网络对于帮助支持系统中水凝胶前体的形状至关重要,因此该策略目前只能应用于水性环境中的材料。为了进一步扩大适用于2D到3D转换策略的材料范围,未来的研究可能涉及设计与油基聚合物兼容的替代牺牲材料。
总体而言,利用远程控制力来实现对材料形状变形的精确控制,并为使用软生物材料设计复杂的3D结构提供了新的机会。这种方法有可能促进工程组织、软机器人技术以及3D和4D打印的未来发展。
五、参考文献
Ruoxiao Xie et al. ,Magnetically driven formation of 3D freestanding soft bioscaffolds.Sci. Adv.10,eadl1549(2024).DOI:10.1126/sciadv.adl1549。
